КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
На правах рукописи
Ралка Марианна Павловна
ПРЕЦИЗИОННАЯ ТЕХНИКА В ХИРУРГИЧЕСКОМ ЛЕЧЕНИИ БОЛЬНЫХ С МЕТАСТАТИЧЕСКИМИ ОЧАГОВЫМИ ОБРАЗОВАНИЯМИ ПЕЧЕНИ
14.00.27 – хирургия
Автореферат диссертации
на соискание ученой степени
кандидата медицинских наук
Краснодар – 2007
Работа выполнена в Кубанском государственном медицинском университете (КГМУ).
Научный руководитель:
доктор медицинских наук профессор
Мануйлов Александр Михайлович.
Официальные оппоненты: доктор медицинских наук профессор
Авакимян Владимир Андреевич;
доктор медицинских наук профессор
Шапошников Александр Васильевич.
Ведущая организация: Ростовский государственный
медицинский университет.
Защита состоится « 4 » мая 2007 г . в 10.00 на заседании диссертационного совета Д208.038.01 при КГМУ (350063, Краснодар, ул. Седина, 4, тел. {861} 262-73-75).
С диссертацией можно ознакомиться в библиотеке КГМУ.
Автореферат разослан « 15 » января 2007 г .
Ученый секретарь
диссертационного совета
профессор Ю.Р.Шейх-Заде
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. За последние годы отмечается тенденция к росту онкозаболеваемости, в структуре которой в 1990 г . злокачественные очаговые образования печени (ЗООП) занимали 8-ое место среди наиболее часто встречающихся злокачественных опухолей, а в 1995 г .- уже 5-ое [В.Ф.Саенко и соавт., 2003; Н.Н.Трапезников и соавт., 2003]. Большую часть среди ЗООП занимает метастатическое поражение печени. Соотношение первичного рака печени к метастатическому поражению составляет около 1:30 [Е.М.Аксель и соавт., 2001].
Без лечения медиана выживаемости, как первичного, так и метастатического рака печени находится в пределах 2-6 месяцев [J.А.Paraskevopoulos, 1994; R.Adam, 2000; C.M.J.van Nieuwkerk et al., 2005].
Xирургическое лечение является «золотым стандартом» у больных, как с первичным, так и с метастатическим поражением печени, но резекция возможна менее чем у 40% пациентов [В.Д.Федоров и соавт., 2003].
Наилучшие показатели выживаемости у больных с изолированным метастатическим поражением печени, подвергшимся резекциям различного объема, были получены при выполнении сегментэктомий и экономных атипичных резекций - по данным хирургического отделения опухолей печени и поджелудочной железы Российского Онкологического Научного Центра им. Н.Н.Блохина Российской Академии Медицинских Наук (РАМН) за 2003 г [Ю.И.Патютко, И.В.Сагайдак, 2003].
Однако количество осложнений и летальных исходов после операций по поводу ЗООП и на сегодняшний день остается достаточно высоким.
Мы видим перспективу в широком применении экономных органосохраняющих резекций при лечении злокачественных метастатических опухолей печени с сочетанным использованием прецизионных хирургических технологий (ПХТ). Также актуально внедренение методов рентгенэндоваскулярной хирургии, в качестве подготовительного малоинвазивного этапа, облегчающего последующее выполнение экономных резекций, когда затруднена дифференцировка анатомических ориентиров сегментов на поверхности печени.
Осуществление предоперационной селективной портальной деваскуляризации (ПСПД) пораженных сегментов печени под ультразвуковым и рентгентелевизионным контролем за 3-4 суток до основного этапа - резекции печени, не успев вызвать развитие компенсаторной викарной гипертрофии остающейся части, способствует образованию четких демаркационных границ портальной ишемии и ведет к редукции эмболизированных сегментов [В.А.Вишневский и соавт., 2003]. Это ведет к возможности выполнения экономных резекций печени фиссуральным способом с минимальной кровопотерей.
Вышеперечисленные данные и послужили основанием для проведения настоящего исследования.
Учитывая вышеизложенное, целью работы явилось улучшение непосредственных результатов хирургического лечения больных с метастатическими очаговыми образованиями печени.
Для достижения указанной цели были поставлены следующие задачи :
1) Разработать и внедрить технологию предоперационной селективной портальной деваскуляризации пораженных сегментов печени под ультразвуковым и рентгентелевизионным контролем при метастатическом поражении печени.
2) Доказать навигационную и ишемическую роль селективной портальной деваскуляризации печени, как первого малоинвазивного этапа перед выполнением резекций.
3) Обосновать адаптационную роль селективной портальной деваскуляризации пораженных сегментов печени перед хирургической «агрессией».
4) Исследовать и оценить эффективность комплексного применения аргоноусиленной электрокоагуляции, ультразвукового дезинтегратора тканей, системы "LigaSure TM", гемостатических пластин и интраоперационного ультразвукового исследования при хирургическом лечении больных с метастатическими очаговыми образованиями печени.
5) Дать оценку комбинированной технологии ультразвуковой селективной портальной деваскуляризации с последующей органосохраняющей резекцией при метастатических опухолях печени.
Новизна результатов исследования
1) Дана оценка эффективности применения комплекса прецизионных хирургических технологий при резекциях печени, выполненных по поводу опухолей метастатического характера.
2) Была применена предоперационная селективная портальная деваскуляризация пораженных сегментов печени за 3-4 суток до выполнения резекции, как метод, вызывающий появление демаркационных ишемических границ на поверхности печени и снижающий интраоперационную кровопотерю.
3) Обоснована навигационная, ишемическая и адаптационная роль предоперационной селективной портальной деваскуляризации перед органосохраняющей резекцией печени.
4) Исследован иммунологический статус больных после применения селективной портальной деваскуляризации печени.
Теоретическая значимость исследования. На основании проведенных исследований доказана эффективность комплекса прецизионных хирургических технологий при выполнении резекций печени по поводу злокачественных опухолей метастатического характера.
Дано теоретическое обоснование применения малоинвазивной предоперационной селективной портальной деваскуляризации печени, как первого этапа хирургического лечения. Получены данные, доказывающие целесообразность выполнения экономных резекций печени по поводу метастатических очаговых образований.
Практическая значимость исследования. Разработана и внедрена технология предоперационной селективной портальной деваскуляризации пораженных сегментов печени под ультразвуковым и рентгентелевизионным контролем, как первого малоинвазивного этапа перед основным оперативным вмешательством при метастатическом очаговом поражении печени. Определены оптимальные сроки выполнения экономных резекций печени после проведения прецизионной эмболизации пораженных сегментов, основанные на изменениях показателей иммунного статуса.
Наряду с этим результаты исследования представляют методический интерес, так как для их получения использована оценка комплекса прецизионных хирургических технологий, впервые апробированная в настоящей работе.
Структура и объем работы. Диссертация изложена на 201 странице и состоит из введения, обзора литературы, 4 глав с описанием методики и результатов исследования, заключения, выводов, библиографии (81 источника на русском и 149 на иностранных языках) и приложений. Работа содержит 27 рисунков и 31 таблицу.
МЕТОДИКА ИССЛЕДОВАНИЯ
С учетом цели и задач исследования нами был обобщен опыт клинического и инструментального обследования 27 больных с метастатическим раком печени, подвергшимся хирургическому лечению – резекции печени, находившихся на лечении в хирургических отделениях Краевого онкологического диспансера (КОД) г. Краснодара, отделении общей хирургии Краевой клинической больницы (ККБ) №1 им. проф. С.В.Очаповского и в хирургическом отделении №1 Муниципального учреждения здравоохранения городской больницы №2 «Краснодарского многопрофильного лечебно-диагностического объединения» (МУЗ ГБ №2 «КМЛДО») с 2000 по 2005 гг. Необходимым условием резекции печени при метастатическом раке печени являлась ликвидация первичного очага. Вторым таким же важным условием, было отсутствие экстраабдоминального распространения.
Контрольную группу (I группа) составили 14 человек, которым были выполнены атипичные экономные резекции печени. В этой группе для профилактики и уменьшения интраоперационной кровопотери активно использовался прием Прингла; выделение сосудисто-секреторных элементов осуществлялось методом дигитоклазии с последующим лигированием или прошиванием; применялась аргоновая монополярная электрокоагуляция. Резецированная поверхность печени ушивалась отдельными швами по Кузнецову-Пенскому с укрытием культи прядью большого сальника.
Основную группу (II группа) составили 13 человек, которым выполняли двухэтапное хирургическое лечение метастатических опухолей печени. Первый малоинвазивный этап заключался в ПСПД пораженных сегментов печени.
Обследование в предэмболизационном периоде включало обязательное ультразвуковое исследование в режиме серой шкалы с применением цветного допплеровского картирования кровотока в комбинации с анализом допплеровского спектра для изучения топографии и сосудистой, особенно портальной, ангиоархитектоники печени. При этом определялось точное топографическое расположение метастатических очагов относительно сегментов и ворот печени, а также порядок ветвей воротной вены (ВВ), осуществляющих кровоснабжение сегмента или субсегмента печени, содержащего злокачественный очаг. Катетеризация ВВ производилась по методике Сельдингера в рентгеноперационной, в условиях местной анестезии 2% раствором новокаина, при необходимости - с внутривенным потенцированием.
Если опухолью была поражена правая доля печени, через нее и выполнялся доступ. В правом межреберье чрескожно чреспеченочно выполняли прицельную пункцию одной из сегментарных ветвей первого порядка под ультразвуковым контролем иглой Chiba 20-22 Grey с рентгенконтрастным кончиком во избежание контакта с имеющейся опухолью. Оптимальным вариантом являлась пункция ВВ V или VII сегмента.
По каналу иглы Chiba, введенной в ветвь ВВ, устанавливался тонкий (0,021) сверхжесткий проводник Лундерквиста, по которому осуществлялось бужирование пункционного канала. После его извлечения под флюороскопическим контролем вводился гибкий проводник с отклоняемым J -кончиком (от 90º до 180º), который проводился селективно в выбранную для эмболизации ветвь ВВ 3-4 порядка. После чего по нему осуществлялось введение интродьюсера под калибр двухканального баллонного катетера (7 Fr ) с длиной баллона в раздутом состоянии 2 см .
Положение катетера в выбранной ветви ВВ контролировалось контрастированием воротной системы (прямая портография) при спавшемся баллоне для детализации особенностей ветвления внутрипеченочных портальных вен, а также обнаружения возможных опухолевых тромбов.
Непременным условием являлась надежная обтурация раздутым баллоном проксимальных отделов ВВ выше ее бифуркации на 15- 20 мм для исключения нецелевой эмболизации соседних сегментов, и во избежание ретроградного попадания эмболизирующих частиц в ствол и контралатеральную ветвь ВВ.
Для выполнения эмболизации мы использовали частицы поливинилалкоголя (ПВА) с диаметром частиц до 500 микрон, разводя один флакон ПВА 10 мл неионного рентгенконтрастного вещества "Омнипак".
Перед введением всего объема частиц, мы выполняли пробную инъекцию небольшого объема для подтверждения устойчивого положения кончика катетера и свободного выхождения из него эмболов. Затем взвесь набиралась в шприц малого объема (3 мл) во избежание создания избыточного давления на катетер, после чего медленно инъецировалась в сосуд через соответствующий канал баллонного катетера под рентгентелевизионным контролем.
После введения нескольких миллилитров взвеси, становилось заметным замедление скорости кровотока в эмболизируемом сосуде. При визуальном снижении скорости наполнения сосуда до 1- 2 см в секунду эмболизацию прекращали, т.к. наступала требуемая окклюзия. После чего выжидали пять минут для наступления взаимодействия частиц ПВА со стенкой сосуда. По истечении этого времени, баллон катетера опорожнялся, и выполнялась контрольная портография для подтверждения выключения соответствующего участка печени из портального кровообращения. Затем удалялся баллонный катетер, интродьюсер извлекался из ВВ по ходу пункционного канала с введением остатков ПВА для профилактики возможного внутрибрюшного кровотечения или оставлялся в паренхиме печени на 24 часа после эмболизации с надежной фиксацией к коже отдельными узловыми капроновыми швами.
Второй этап осуществлялся через 3-4 суток, когда выполнялась экономная резекция печени по демаркационным границам развившейся портальной ишемии. Применялся комплекс ПХТ, включающих: аргоноусиленную электрокоагуляцию, ультразвуковой дезинтегратор ткани - используемый для диссекции паренхимы, аппарат "LigaSure TM " - для выполнения диссекции и транссекции печени. Для окончательного гемостаза на резецированную поверхность культи печени осуществлялась аппликация гемостатических пластин. Всем больным данной группы выполнялось интраоперационное ультразвуковое исследование (ИОУЗИ) печени.
Результаты исследования обработаны параметрическими и непараметрическими методами вариационной статистики.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Одним из основных показателей, характеризующих эффективность применения комплекса ПХТ и методики ПСПД пораженных сегментов печени, являлась интраоперационная кровопотеря (см. рис.1.). В основной группе средние значения интраоперационной кровопотери были ниже, чем в контрольной группе практически в два раза (650 мл против 1400 мл), р<0,01.
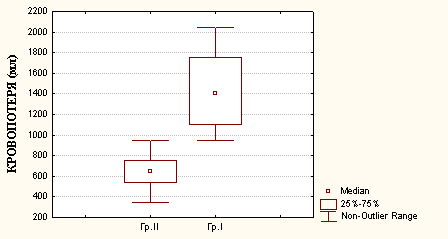
Рис.1. Интраоперационная кровопотеря при резекциях печени в сравниваемых группах.
Примечания: Гр. I - контрольная группа, Гр. II - основная группа; Median - медиана, 25%-75% - 25 процентиль-75 процентиль, Non - Qutlier Range - размах квартилей.
При этом пережатие гепатодуоденальной связки во время резекций применялось практически у всех больных I группы на различных этапах операции (преимущественно во время диссекции паренхимы). У больных II группы прием Прингла также применялся, но в основном на завершающем этапе операции - перед аппликацией гемостатических пластин и с меньшей продолжительностью. Частота использования приема Прингла во время операций и общее время печеночной ишемии у сравниваемых групп приведены в таблицах 1 и 2.
Таблица 1
Использование приема Прингла во время резекций у обследованных больных (n =27)
Показатель |
I группа
(n=14) |
II группа
(n=1 3 ) |
Применение приема Прингла, чел.(%) |
14 (100) |
11 (73,3) * |
Общее количество применений |
34 |
12 |
Примечание: * - представлено достоверное отличие от показателей контрольной группы (р<0,05), (difference test ).
Таблица 2
Общее время печеночной ишемии, вызванное пережатием гепатодуоденальной связки (n =27)
|
Показатель, мин
|
Статистические
показатели
|
I группа
(n=14)
|
II группа
(n=13)
|
|
Общее время интраоперационной ишемии печени
|
Диапазон
|
2-45
|
2-15
|
|
Q25
|
14
|
3
|
|
Me
|
20,5
|
4*
|
|
Q75
|
28
|
5
|
Примечания: такие же, как на рис. 1.
Как видно из данных таблиц, средние значения продолжительности ишемии печени в результате применения приема Прингла у больных II группы были ниже, чем в I группе почти в 5 раз (4 мин против 20,5 мин). В I группе наблюдалась умеренная прямая корреляционная зависимость между развитием печеночной недостаточности в раннем послеоперационном периоде и временем интраоперационной ишемии печени.
У пациентов сравниваемых групп во время резекций производилась аппаратная реинфузия отмытых аутоэритроцитов с помощью аппарата "Cell Saver". Показанием к его развертыванию была кровопотеря более 700 мл. Не смотря на применение реинфузии с помощью "Cell Saver" у всех пациентов группы контроля, трансфузии компонентов крови осуществлялись также во всех случаях в данной группе. Тогда как во II группе необходимость в гомологичных интраоперационных трансфузиях возникла у 4 пациентов (30,8%), а "Cell Saver" развертывался в 3 (23,08%) наблюдениях. Потребовалось достоверно меньшее количество упаковок эритроцитарной массы и свежезамороженной плазмы (p<0,05) для восполнения кровопотери во время операции у больных II группы.
Итак, можно судить о высокой эффективности методики ПСПД и применения комплекса ПХТ во время выполнения экономных резекций печени по поводу злокачественных опухолей метастатического характера уже во время операции.
В комплекс стандартных исследований была включена оценка иммунограммы с определением следующих кластеров дифференцировки (CD): CD 3+ (Т-лимфоциты), CD 4+ (Т-хелперы / индукторы), CD 8+ (Т-супрессоры / цитотоксические лимфоциты), CD 20+ (В-лимфоциты / антигенпредставляющие клетки). Также определялись значения иммунорегуляторных индексов (ИРИ) супрессии (CD 4+ / CD 8+) и показателей, характеризующих фагоцитарную активность в следующие сроки: с момента получения травмы (эмболизации ветвей воротной вены) до относительного восстановления исходного гомеостаза, т.е. периода достижения срочной адаптации (на 4-ые сутки после ПСПД) в основной группе, а также на 7-ые сутки после резекции печени в обеих группах.
Таблица 4
Основные показатели ( M ± σ;± m ) клеточного звена иммунитета у обследованных больных ( n =27)
|
Показатель
|
Группы |
Исх.
уровень |
После
эмболизации |
После
резекции |
|
Лейкоциты
(х10 9/л)
|
I
|
8,3±2,6;
±1,88 |
10,5±1,55;
±0,09 |
12,17±2,55;*
±0,09 |
|
II |
7,9±2,3;
±0,58 |
– |
16,12±3,46;
±0,08 |
|
Лимфоциты ♦
|
I
|
15,3±4,66;
±0,74 |
21,7±4,16;
±1,99 |
23,7±2,16;*
±0,93 |
|
II |
17,4±5,08;
±0,91 |
– |
29,7±1,18;
±1,88 |
|
Т-лимфоциты
(CD 3+) ♦
|
I
|
32,7±6,55;
±0,46 |
67,1±15,25;
±3,99 |
55,4±9,11;*
±2,87 |
|
II |
35,2±7,91;
±1,25 |
– |
63,7±12,17;
±1,97 |
|
Т-хелперы
(CD
4+) ♦ |
I
|
27,8±1,27;
±0,49 |
38,9±6,16;
±2,57 |
32,8±4,35;*
±1,86 |
|
II |
25,8±1,11;
±0,39 |
– |
38,1±0,78;
±0,56 |
|
Т-супрессоры
(CD 8+) ♦ |
I |
12,5±2,56;
±0,31 |
29,8±2,56;
±0,89 |
27,7±1,59;
±0,44 |
|
II |
11,2±3,47;
±0,21 |
– |
25,4±1,19;
±0,42 |
|
ИРИ (усл. ед.)
CD 4+ / CD 8+ |
I |
1,48±0,15;
±0.02 |
2,30±0,08;
±0,12 |
1,60±0,05;*
±0,02 |
|
II |
1,27±0,15;
±0.01 |
– |
2,46±0,08;
±0,01 |
|
В-лимфоциты
(CD 20+) ♦ |
I |
4,11±0,38;
±0,01 |
22,1±1,44;
±0,15 |
8,29±2,01;*
±0,13 |
|
II
|
5,02±0,44;
±0,03
|
–
|
11,36±3,02;
±0,14
|
Примечания: ♦ – (% /абс. число х 10%); * - представлены достоверные отличия в основной группе на 7-ые сутки после резекции печени по сравнению с группой контроля ( p <0,05); подчеркнутые значения показателей означают достоверные отличия по сравнению с исходным уровнем в обеих группах ( p <0,05); жирным контуром выделены значения исследуемых показателей основной группы после резекций, имеющие достоверные отличия от значений, полученных на 4-ые сутки после ПСПД ( p <0,05), ( summary t – test по Стьюденту).
Динамика показателей иммунного статуса дана в таблицах 4, 5 и 6.
Как мы видим, исходные значения показателей иммунограммы в сравниваемых группах не имели достоверных отличий между собой.
В результате изучения клеточного иммунитета в постэмболизационном периоде у пациентов основной группы выявлены следующие особенности протекания стрессовой адаптационной реакции: достоверное увеличение числа лейкоцитов до 10,5х10 9 /л, лимфоцитов до 21,7%; тенденция к увеличению Т-лимфоцитов до 67,1%, В-лимфоцитов до 22,1%.
Таблица 5
Динамика показателей ( M ± σ; ± m ) гуморального иммунитета у обследованных больных ( n =27)
|
Показатель
|
Группы
|
Исх.
уровень
|
После
эмболизации
|
После
резекции
|
|
Ig ♦G (г/л)
|
I
|
5,12+0,08;
±0.01
|
12,3±3,88;
±0,51
|
11,7±1,09;*
±0,04
|
|
II
|
6,05+0,09;
±0.01
|
–
|
5,7±1,01;
±0,02
|
|
Ig ♦А (г/л)
|
I
|
0,94±0,31;
±0.02
|
2,67±0,43;
±0,02
|
2,28±0,32;*
±0,07
|
|
II
|
1,31±0,56;
±0.11
|
–
|
1,09±0,02;
±0,06
|
|
Ig ♦M (г/л)
|
I
|
0,22±0,04;
±0.01
|
1,61±0,27;
±0,01
|
1,37±0,21;*
±0,06
|
|
II
|
0,19±0,03;
±0.01
|
–
|
0,39±0,06;
±0,06
|
Примечания: ♦ - иммуноглобулин; * - представлены достоверные отличия в основной группе на 7-ые сутки после резекции печени по сравнению с группой контроля (p <0,05) ; подчеркнутые значения показателей означают статистически достоверные отличия по сравнению с исходным уровнем в обеих группах (p <0,05), (summary t – test по Стьюденту).
При изучении гуморального звена иммунитета в основной группе после эмболизации ветвей ВВ было выявлено достоверное повышение уровня иммуноглобулинов класса G, A и менее выраженное повышение иммуноглобулина M по сравнению с исходным уровнем. В группе контроля, напротив, мы наблюдали снижение иммуноглобулинов G , А в послеоперационном периоде.
Таблица 6
Динамика показателей ( M ± σ; ± m ), отражающих фагоцитарную функцию у обследованных больных (n=27)
|
Показатель
|
Группы
|
Исх.
уровень
|
После
эмболизации
|
После
резекции
|
|
Фагоцитарная
активность
нейтрофилов
(% фагоцитоза)
|
I
|
29,3±4,77;
±0.19
|
69,4±10,09;
±0,26
|
63,7±20,73;*
±0,45
|
|
II
|
27,2±3,99;
±0.21
|
–
|
33,2±4,79;
±0,05
|
|
Фагоцитарное число (усл.ед.) |
I
|
1,9±0,56;
±0,01
|
2,7±0,16;
±0,09
|
2,5±1,18;
±0,08
|
|
II
|
2,04±0,78;
±0,01
|
–
|
2,07±0,14;
±0,19
|
|
Фагоцитарный
Индекс (усл.ед.)
|
I
|
1,34±0,19;
±0,01
|
3,17±0,21;
±0,05
|
3,45±0,91;*
±0,15
|
|
II
|
1,28±0,22;
±0,03
|
–
|
1,29±0,15;
±0,02
|
|
Абсолютный показатель поглощения
(усл.ед.)
|
I
|
2,1±0,55;
±0,06
|
2,9±0,25;
±0,09
|
2,6±0,21;*
±0,07
|
|
II
|
2,2±0,81;
±0,21
|
–
|
1,7±0,47;
±0,02
|
|
Процент бактерицид-ности
|
I
|
49,8±11,27;
±2,41
|
52,9±6,16;
±0,57
|
50,6±9,11;*
±0,33
|
|
II
|
47,9±5,11;
±0,39
|
–
|
38,1±0,78;
±0,56
|
|
Индекс бактерицид-ности
(усл.ед.) |
I
|
1,5±0,52;
±0,21
|
2,7±0,59;
±0,24
|
2,9±0,64;*
±0,04
|
|
II
|
1,8±0,49;
±0,19
|
–
|
1,4±0,26;
±0,02
|
Примечания: достоверные отличия обозначены так же, как в таблице 5.
При изучении показателей фагоцитарной активности, было выявлено достоверное повышение индекса фагоцитоза после ПСПД и тенденция к повышению остальных показателей по сравнению с группой контроля, где наблюдалась тенденция к снижению большинства показателей после резекции печени. В послеоперационном периоде у пациентов, которым применялось двухэтапное хирургическое лечение, была зафиксирована более быстрая нормализация ИРИ, иммуноглобулинов класса A , G , M .
Итак, был выявлен эффект иммуностимуляции после выполнения ПСПД в основной группе, выражавшийся в повышении числа Т-лимфоцитов и их субпопуляций с нормализацией показателя иммунорегуляторных отношений хелперов и супрессоров после резекции печени, а также в более раннем восстановлении концентрации иммуноглобулинов всех классов и повышении фагоцитарной активности нейтрофилов в постэмболизационном периоде.
Блокируя с помощью ПСПД портальное русло сегментов, содержащих метастатические очаги (см. рис. 2.), мы добивались существенного снижения интраоперационной кровопотери при последующих резекциях, за счет развивающейся ишемии паренхимы печени, окружающей подлежащий удалению очаг.
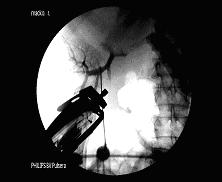 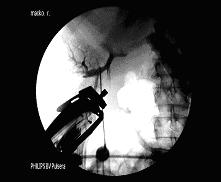
Рис.2. Портограммы б-ой М., 63 лет с метастатическим поражением VI и VII сегментов.
Примечания: а - обзорная портограмма, выполненная до эмболизации; б - контрольная портограмма после селективной эмболизации ветвей воротной вены VI и VII сегментов. Причем во всех случаях применения данной методики демаркационная граница индуцированной эмболизацией ишемии проходила на расстоянии не менее 1 см от определяемых границ злокачественного очага, что соответствовало требованиям онкологической курабельности.
Даже визуально, еще до оценки общей кровопотери, кровоточивость паренхимы была заметно снижена, чем при традиционном выполнении резекций, за счет запустевания сосудов портальной системы, вызванных ПСПД. При этом техника выполнения резекций сводилась к фиссуральному способу. Наша методика позволила осуществить выполнение органосохраняющих оперативных вмешательств в объеме сегментэктомий по принципу оперирования «к сосудам», что существенно упрощало техническое выполнение операций.
Общие тенденции послеоперационного периода сравниваемых групп, рассчитанные в средних величинах (медианах) по шкале APACHE II, отражены на рисунке 3. Высокая оценка в баллах в группах соответствовала тяжелому течению послеоперационного периода с большей вероятностью развития осложнений. Из приводимой диаграммы, мы видим, что исходная оценка показателей до операции в сравниваемых группах не имела достоверных отличий между собой. Но уже на первые сутки после резекции печени мы видим достоверное отличие между баллами, набранными I и II группами (р<0,01), с более высокими показателями в группе контроля, которые сохраняются до 7-ых суток после резекции. На 14-ые сутки после резекции печени достоверное отличие между баллами, набранными пациентами сравниваемых групп возобновляется также с более низкими значениями во II группе.
Эти данные свидетельствует о более благоприятном течении послеоперационного периода у пациентов II группы.
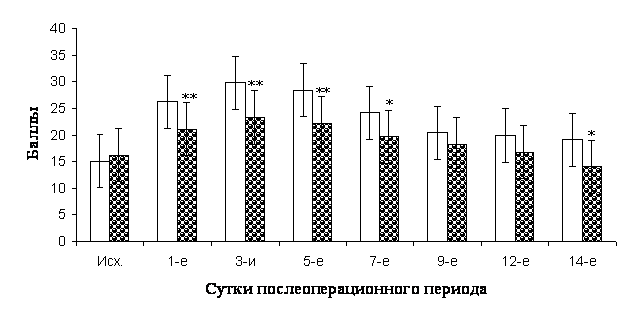
Рис. 3. Динамика общего состояния и основных клинико-лабораторных показателей обследованных пациентов в послеоперационном периоде, рассчитанная по шкале APACHE II.
Примечания:  - I группа, - I группа,  - II группа; * – представлены достоверные отличия от показателей контрольной группы (p <0,05), ** – представлены достоверные отличия от показателей контрольной группы (p <0,01), (Mann - Whitney U test ). - II группа; * – представлены достоверные отличия от показателей контрольной группы (p <0,05), ** – представлены достоверные отличия от показателей контрольной группы (p <0,01), (Mann - Whitney U test ).
Можно отметить, что в основной группе отмечалась более ранняя активизация больных (на 2-ые сутки против 6 суток в группе контроля); быстрее происходило восстановление моторики ЖКТ (на 2-ые против 4,25 суток). Стабилизация температурной реакции до нормальных значений наступила быстрее также в основной группе (на 3 сутки против 7-ых в группе контроля).
Послеоперационные осложнения различного характера развились у 13 пациентов (92,86%) группы контроля и у 4 пациентов (30,77%) основной группы хирургического лечения. Из них у 9 пациентов (64,29%) группы контроля наблюдалось сочетание осложнений - например, интраоперационная кровопотеря >1000 мл с развитием гипохромной анемии + гематома в зоне резекции. В основной группе сочетанные осложнения развились у 3 пациентов (23,08%). Характер осложнений и их процентное отношение к общему числу пациентов исследуемых групп представлены в таблице 7.
Таблица 7
Осложнения, развившиеся после резекций печени (n =27)
Характер осложнений,
чел.(%) |
I группа
( n =14) |
II группа
( n =13) |
Интраоперационное кровотечение
>1000 мл, но ≤ 2000 мл с развитием гипохромной анемии |
10 (71.4) |
- |
Интраоперационное кровотечение
>1000 мл, но ≤ 2000 мл с развитием ДВС-синдрома |
1 (7.1) |
- |
Полиорганная недостаточность |
1 (7.1) |
- |
Послеоперационное кровотечение из
культи печени |
1 (7,1) |
- |
Тромбоэмболия мелких ветвей легочной артерии |
1 (7.1) |
1 (7.7) |
Гематома в зоне резекции |
2 (14.3) |
- |
Билома в зоне резекции |
1 (7.1) |
1 (7.7) |
Абсцессы в зоне резекции |
1 (7.1) |
- |
Подпеченочный абсцесс |
1 (7.1) |
2 (15.4)* |
Наружный желчно-гнойный свищ |
1 (7.1) |
- |
Пневмония, плеврит |
2 (14.3) |
3 (23.1)* |
Примечания: * - представлены достоверные отличия от показателей контрольной группы (p <0,05), (difference test ).
В сравниваемых группах, где выполнялись экономные резекции печени, не смотря на большой удельный вес развившихся осложнений, показатели послеоперационной летальности были не высоки. Так, в основной группе не было зарегистрировано ни одного случая с летальным исходом, соответственно показатель послеоперационной летальности составил в этой группе 0%. В контрольной группе летальный исход наступил у двух пациентов, что составило 14,29% послеоперационной летальности. В одном случае причиной летального исхода была массивная интраоперационная кровопотеря с развитием ДВС-синдрома на 2-ые сутки после резекции печени, в другом случае – полиорганная недостаточность, индифферентная к проводимой интенсивной терапии, развившаяся на 4-ые сутки послеоперационного периода. Средние значения показателей койко-дней пребывания в стационаре пациентов, прооперированных по поводу метастатических опухолей печени, отражены в таблице 5.
Таблица 8
Показатели койко-дней ( M ±σ; ± m ), проведенных пациентами после резекции печени по поводу злокачественных опухолей ( n =25)
|
Койко-день,
(сутки)
|
I группа
(n=11)
|
II группа
(n=14)
|
|
20.92±4.25,
±1.18
|
15.92±1.8,*
±0.5
|
Примечание: * - представлено достоверное отличие от показателей контрольной группы ( p <0,01), (summary t – test по Стьюденту).
Показатели койко-дня в группе контроля были достоверно ниже, чем в основной группе. Этому способствовало как более тяжелое течение послеоперационного периода, так и большее количество послеоперационных осложнений в группе, где применялись традиционные хирургические технологии при выполнении экономных атипичных резекций.
ВЫВОДЫ
1. Предоперационная селективная портальная деваскуляризация пораженных метастазами сегментов печени может быть надежно выполнена под ультразвуковым и рентгентелевизионным контролем.
2. Применение селективной портальной деваскуляризации сегментов перед резекцией печени у больных с метастатическими опухолями позволяет определить оптимальный объем удаляемой части печени за счет образования демаркационных границ портальной ишемии и выполнить органосохраняющий вариант хирургического вмешательства с минимизацией интраоперационной кровопотери.
3. Селективная портальная деваскуляризация печени, выполненная за несколько суток (до 4) до резекции сегментов печени, позволяет позитивно влиять на адаптационную роль организма, что проявляется в тенденции к увеличению Т-лимфоцитов до 67,1%, В-лимфоцитов до 22,1%; повышении уровня иммуноглобулинов класса G, A и М, а также в повышении фагоцитарной активности нейтрофилов в постэмболизационном периоде.
4. Использование технологических приемов диссекции тканей с помощью ультразвукового дезинтегратора тканей, поэтапного гемостаза аппаратом "LigaSure TM ", интраоперационной навигации с помощью ультразвукового контроля, применения аргоноусиленной электрокоагуляции на всех этапах резекции, а также аппликации на резецированную поверхность гемостатических пластин при резекциях печени по поводу метастатических опухолей позволило снизить операционный риск и добиться снижения послеоперационной летальности на 14,29% в сравнении с группой больных оперированных традиционными хирургическими технологиями.
5. Двухэтапное хирургическое лечение, включающее предоперационную селективную портальную деваскуляризацию сегментов печени, несущих метастатические узлы с последующей органосохраняющей резекцией, во время которой используются вышеописанные технологические приемы, является тем базисом, который позволяет снизить количество осложнений и уменьшить их тяжесть, добившись более благоприятного течения послеоперационного периода.
РАБОТЫ, ОПУБЛИКОВАННЫЕ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Мануйлов А.М., Ралка М.П. Прецизионная техника в комплексном хирургическом лечении больных с очаговыми метастатическими поражениями печени // Совр. состояние и перспективы развития медицины: сб. науч. статей / Воронежская государственная медицинская академия. - Воронеж, 2006.- Т. 1.- С. 135-138.
2. Ралка М.П. Комплексное хирургическое лечение больных злокачественными очаговыми образованиями печени // Современ. проблемы науки и образования: тез. докл. 67 конф. СНО Кубанского государственного медицинского университета.- Москва; Краснодар, 2006.- №4, приложение №1.- С. 141.
3. Ралка М.П. Техника выполнения экономных резекций печени по поводу метастазов колоректального рака после применения пункционной ультразвуковой селективной портальной деваскуляризации пораженных сегментов // Естеств. и техн. науки.- 2006.- №3 (23).- С. 96-99.
4. Мануйлов А.М., Ралка М.П. Прецизионные технологии в хирургическом лечении метастатических опухолей печени // Кубанский научный медицинский вестник.- 2006.- №10 (91).- С. 56-59.
5. Ралка М.П. Применение щадящих хирургических технологий в лечении больных с очаговыми поражениями печени злокачественного характера // Вопросы теоретической и клинической медицины: сборник научных трудов, посвящ. 85-летию со дня основания Краснодарского Военного госпиталя.- Краснодар, 2006.- С. 313-317.
|

