| | ||||||||
| |
В.А. Авакимян, М.Т. Дидигов, С.В. Авакимян НЕПРЯМОЕ ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ В ЛЕЧЕНИИ РАСПРОСТРАНЕННОГО ПЕРИТОНИТАМногоуважаемый председатель, присутствующие коллеги! Интерес к различным аспектам проблемы распространенного перитонита объясняется как увеличением количества больных , так и высокой летальностью , составляющей по данным ряда отечественных и зарубежных авторов от 12 до 35%. При этом имеет место прямая корреляция между уровнем летальности и степенью распространенности перитонита и характером перитонеального экссудата. По данным проф. В.И. Шапошникова, летальность при местном перитоните колеблется от 1,8% до 3,7%, при диффузном - от 9,5% до18,5%, при разлитом – от 70 до 90%. Лечение больных с распространенным перитонитом представляет собой сложную и актуальную проблему неотложной хирургии, далеко не решенную до конца. Распространенный перитонит является не локальным, а общим заболеванием организма и сопровождается тяжелыми нарушениями его внутренней среды. Развитие сдвигов гомеостаза происходит лавинообразно. По этой причине одно лишь хирургическое вмешательство с устранением причины перитонита обычно не приводит к желаемому результату. Комплексное лечение перитонита включает следующие, патогенетически обоснованные этапы: 1). Адекватная и по показаниям проведенная предоперационная подготовка. 2). Хирургическое вмешательство. 3). Рациональная антибиотикотерапия. 4). Борьба с полиорганной недостаточностью, эндотоксикозом, включающая методы интра- и экстракорпоральнрой детоксикации. Принципы хирургического вмешательства при перитоните на современном этапе хорошо известны. Они включают устранение или отграничение источника перитонита, адекватную санацию и дренирование брюшной полости, декомпрессию желудочно-кишечного тракта с целью снижения эндогенной интоксикации, борьбы с паралитической кишечной непроходимостью. В структуре непосредственных причин летальных исходов у данного контингента больных главенствующее место занимает полиорганная недостаточность на фоне высокой степени эндогенной интоксикации. Эндотоксикоз при перитоните носит сложный, многокомпонентный характер. Решающее значение приобретают постепенное истощение функционального потенциала печени на фоне прогрессирования токсемии, развитие системных микроциркуляторных расстройств в органах и тканях, нарушение клеточного метаболизма. Дегенеративно-деструктивные изменения в клетках и тканях носят при этом достаточно универсальный характер, определяемый, главным образом, гипоксией. Они сводятся к дестабилизации ультраструктурных мембран и нарушению окислительного фосфорилирования, являющегося узловым компонентом энергетического обмена. Фактором, оказывающим существенное влияние на развитие синдрома эндогенной интоксикации, является повышение уровня среднемолекулярных пептидов, нарушающих функции ЦНС, вызывающих развитие иммунодефицита, расстройства гемодинамики. Мощным источником эндогенной интоксикации при перитоните является кишечник, где на фоне паралитической кишечной непроходимости развиваются процессы брожения и гниения, пролиферирует патогенная микрофлора и происходит всасывание токсинов. В настоящее время в клинической практике для лечения многих заболеваний воспалительного характера с успехом применяется метод электрохимического окисления с использованием гипохлорита натрия , позволяющий получить высокий детоксикационный , антимикробный и реологический эффект. Целью настоящего исследования являлось повышение эффективности лечения больных с распространенным перитонитом путем разработки комплекса лечебных мероприятий с использованием метода непрямого электрохимического окисления. Наш клинический опыт основан на лечении 140 больных с распространенными формами перитонита, находившихся в клинике госпитальной хирургии Кубанской государственной медицинской академии с 2001 по 2006 год. Общая характеристика пациентов представлена в таблице 1. Таблица 1 Общие сведения о больных
В основную группу было включено 48 больных, в комплексном лечении которых был использован гипохлорит натрия. 92 человека лечились традиционно. Результаты обследования и лечения этих больных составили контрольную группу наблюдений. У всех больных имелся распространенный перитонит различного генеза. Сведения об этиологии перитонита представлены в таблице 2. Таблица 2 РАСПРЕДЕЛЕНИЕ БОЛЬНЫХ ПО ЭТИОЛОГИИ ЗАБОЛЕВАНИЯ
Как видно из таблицы, основными причинами развития распространенного перитонита в нашем исследовании являлись перфоративные гастродуоденальные язвы, острая странгуляционная кишечная непроходимость с некрозом кишки и деструктивный аппендицит. Данные о степени распространенности перитонита приведены в таблице 3. Таблица 3 СТЕПЕНЬ РАСПРОСТРАНЕННОСТИ ПЕРИТОНИТА
Преобладал разлитой перитонит, который имел место у 75% больных основной группы и 78,3% больных контрольной группы. Виды перитонита по характеру экссудата представлены в таблице 4. Таблица 4 ВИДЫ ПЕРИТОНИТА ПО ХАРАКТЕРУ ЭКССУДАТА
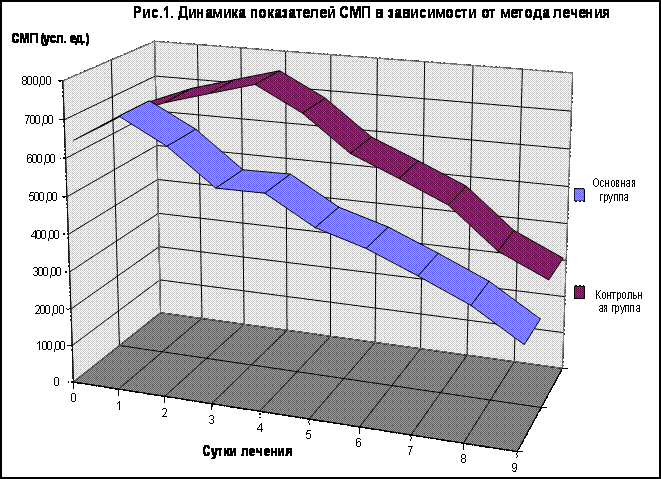
Основную массу составил фибринозно-гнойный перитонит – 70,8% больных основной группы и 72,8% больных контрольной группы. Растворы гипохлорита натрия различной концентрации использовали местно и внутривенно. Инфузию гипохлорита натрия проводили в подключичную вену, катетеризированную по Сельдингеру в течение одного, двух или трех дней по 200 мл два раза в сутки в зависимости от степени эндотоксикоза. Концентрация раствора для внутривенного введения составляла 600 мг/л. Во время операции осуществляли санацию брюшной полости раствором фурацилина и затем однократную санацию раствором гипохлорита натрия в концентрации 600 мг/л. Брюшную полость тщательно осушали и дренировали полихлорвиниловыми дренажами , после чего в нее вводилось 400 мл раствора гипохлорита натрия , дренажные трубки при этом пережимали. Лапаротомная рана ушивалась послойно. Зажимы удалялись в течение часа. Сразу после вскрытия брюшной полости производили посев экссудата на флору и чувствительность к антибиотикам. В случае нагноения операционной раны края ее разводили, рану санировали раствором гипохлорита натрия в концентрации 800 мг/л, осушали и рыхло дренировали тампонами с раствором гипохлорита натрия той же концентрации. Перевязки производили один раз в сутки до полного очищения раны и появления сочных грануляций, после чего применяли вторичный шов. Выделение и идентификацию микроорганизмов осуществляли общепринятыми бактериологическими методами. Адекватно оценить эффективность детоксикации при непрямом электрохимическом окислении позволяют такие лабораторные методы , как определение уровня среднемолекулярных пептидов , эффективной концентрации альбумина плазмы крови и лейкоцитарного индекса интоксикации. Результаты анализа динамики среднемолекулярных пептидов (рис. 1) свидетельствуют , что при поступлении у всех обследуемых больных отмечено существенное повышение уровня средних молекул. В раннем послеоперационном периоде имеет место некоторый рост показателя , что , на наш взгляд , обусловлено дополнительной операционной травмой , наличием послеоперационной паралитической кишечной непроходимости и ранним посленаркозным периодом. При этом пик уровня среднемолекулярных пептидов среди больных основной группы приходится на 1-е сутки послеоперационного периода , а среди пациентов контрольной группы - на 3-и сутки. У пациентов основной группы , начиная со вторых суток отмечается снижение уровня средних молекул и к 8 - 9 суткам этот показатель достигает нормальных значений. Среди больных контрольной группы наблюдался прогрессивный рост показателя до 3-4 суток включительно и затем отмечали тенденцию к его постепенному снижению. При этом на 8-9 сутки уровень среднемолекулярных пептидов существенно превышал нормальные цифры.
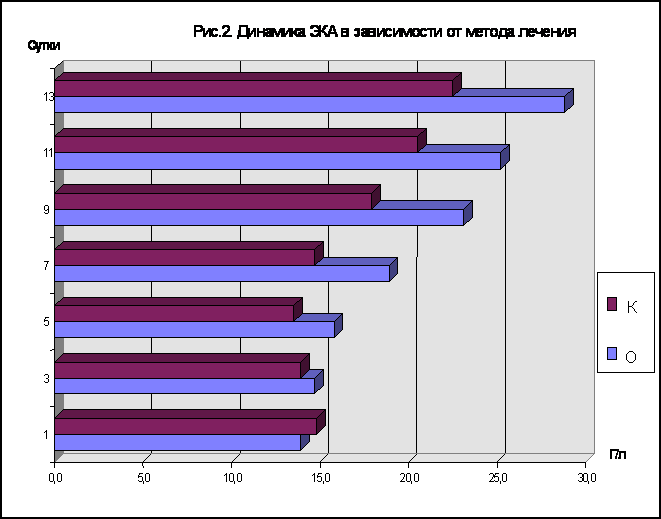
Проведенный анализ динамики эффективной концентрации альбумина выявил следующие закономерности (рис. 2). В основной группе пациентов максимальное снижение показателя приходилось на 1-2-е сутки послеоперационного периода. В последующем наблюдали прогрессивное увеличение эффективной концентрации альбумина , которая максимально приближалась к общей концентрации на 12 - 13-е сутки после операции. В контрольной группе наблюдали снижение показателя до 3 - 4-х суток послеоперационного периода и только с 5-6-х суток отмечалась тенденция к его росту.
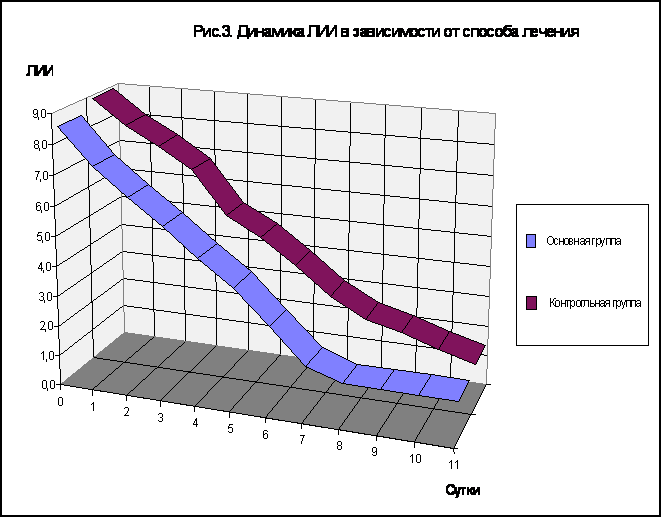
При сравнении изменений эффективной концентрации альбумина в основной и контрольной группах выявлено более значительное увеличение данного показателя при комбинированном применении гипохлорита натрия , что , по-видимому , связано с окислением и последующим удалением гепатотропных веществ из организма и стимуляцией детоксицирующей функции печени. Стимуляция биотрансформационных способностей клеток печени под влиянием гипохлорита натрия приводит к увеличению свободных центров связывания альбумина. Динамика ЛИИ , определяемого по методу Кальф-Калифа представлена на рисунке 3. Как видно из рисунка , максимальное значение ЛИИ имел в первые сутки послеоперационного периода. Начиная со вторых суток отмечали снижение показателя в обеих группах больных , однако в контрольной группе уровень его оставался в среднем на 10-15% выше , чем в основной. К 8 - 9-м суткам послеоперационного периода у пациентов основной группы ЛИИ был < 1. В контрольной группе нормализацию показателя наблюдали на 12-14-е сутки после операции.
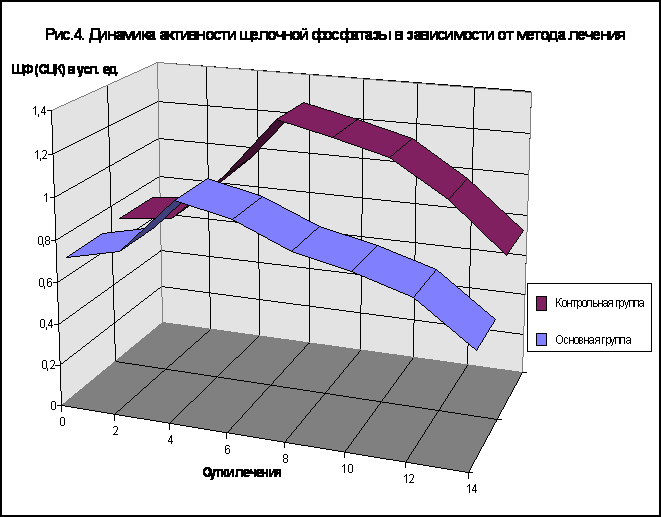
О напряженности окислительно-восстановительных процессов в организме и степени выраженности системного воспалительного ответа свидетельствуют изменения активности различных ферментов нейтрофилов. Одним из таких ферментов является щелочная фосфатаза (рис. 4) . В контрольной группе больных средний цитохимический коэффициент щелочной фосфатазы прогрессивно нарастал до 6-8-х суток послеоперационного периода. На 9-10-е сутки наблюдалось снижение фосфатазной активности, которая на 14-е сутки достигала 0,80 ± 0,032 условных единиц и длительно оставалась выше нормальных величин.
В основной группе максимальный уровень фосфатазной активности нейтрофильных лейкоцитов наблюдали на 4-е сутки послеоперационного периода, в дальнейшем имело место снижение показателя , который достигал к 13-14-ым суткам нормальных значений. Сравнительный анализ результатов лечения с применением традиционных методов и метода непрямого электрохимического окисления представлен таблице 5. Таблица 5 Сравнительные данные лечения больных с распространенным перитонитом
Комбинированное использование метода позволило снизить послеоперационную летальность с 29,3% до 18,8% , сократить средние сроки пребывания больных в стационаре , существенно уменьшить частоту гнойных послеоперационных осложнений. Предлагаемый метод, безусловно, не решает всех имеющихся проблем, не является панацеей, но занимает свое обособленное место в имеющемся арсенале сил и средств эфферентной терапии. Благодарю за внимание ! Пятаков Станислав Николаевич Глубокоуважаемый председатель, уважаемые коллеги! Разрешите представить Вашему вниманию доклад «Тактические подходы и хирургические доступы при лечении больных с обширными флегмонами шеи в сочетании с трахеостомой».Увеличение в последнее время частоты гнойно-воспалительных заболеваний лица и шеи, а также топографо-анатомические особенности локализации патологического процесса, предрасполагающие к его неограниченному распространению, отсутствие четких показаний к трахеостомии при обширных флегмонах шеи и неудовлетворительные результаты их лечения диктуют необходимость разработки тактики, позволяющей сочетать трахеостомию с радикальной хирургической обработкой. Целью работы явилось улучшение результатов лечения больных с обширными флегмонами шеи в сочетании с трахеостомой. В основу исследования положены результаты лечения 138 больных с обширными флегмонами шеи, в том числе 86 в сочетании с трахеостомией. Больные были разделены на три основные и одну контрольную группу . Группа А включала 25 больных, которым при оперативном пособии накладывалась трахеостома и производился хирургический доступ с отграничением от трахеотомной раны в виде арки по предложенной нами методике. Группа B включала 19 больных, которым трахеостома накладывалась через операционную рану основного хирургического доступа, и использовалось приспособление для дренирования паратрахеостомической раны. Группа C включала 52 больных, которым при оперативном пособии производилась интубация по бронхоскопу и хирургическая обработка обширной флегмоны шеи. Во всех основных группах применялись разработанные нами тактические подходы и алгоритмы. Контрольная группа D включала 42 больных, которым выполнялась хирургическая обработка флегмоны шеи с наложением трахеостомы без использования предложенных нами методик. В изучаемых группах больные были сопоставимы по характеру заболеваний, этиологии, возрасту и полу. Проведенный анализ этиологических факторов показал, что наиболее частыми причинами флегмон шеи являлись: кариозный зуб у 64 больных, тонзиллит у 28 больных и гнойный лимфаденит у 13 больных. Анаэробный неклостридиальный характер флегмоны шеи был диагностирован у 20 больных группы A , у 14 группы B , у 25 группы C и у 33 больных группы D . Тяжесть общего состояния больного оценивалась на момент поступления по шкале SAPS II . Средний балл по шкале SAPS II составили: в группе A – 22,1 балла и 47,3 ‰ ; в группе B – 22,9 и 51,6 ‰ ; в группе C – 21,0 и 41,8 ‰ ; в группе D – 21,8 балла и 45,7 ‰ . Из представленных данных видно, что уже на момент поступления больных тяжесть их состояния оценивалась достаточно высоко. Нами разработаны тактические подходы и предложены следующие методы и устройства: 1. способ хирургического лечения больных с обширными флегмонами шеи; 2.инструмент для инсуффляции кислорода в трахеобронхиальное дерево; 3. приспособление для дренирования паратрахеостомической раны. Перед тем как охарактеризовать инструмент для инсуффляции кислорода, хотелось бы остановиться на методике транстрахеальной струйной апнойной оксигенации, предложенной Мельцером и Ауэром. Она заключается в проведении струйной искуственной вентиляции легких кислородом через катетер с внутренним диаметром 1,5- 2 мм , введенным через голосовую щель в трахею на 1- 2 см выше бифуркации. Технической новизной предлагаемого нами инструмента является то, что игла проведена через специальный щиток, способный передвигаться по длине иглы и фиксироваться к ней. Это позволяет проводить иглу в просвет трахеи таким образом, чтобы избежать травмирование или перфорацию задней стенки. Кроме того, создается возможность учитывать толщину мягких тканей, расположенных над гортанью и трахеей, которая строго индивидуальна у каждого больного и может меняться в зависимости от величины инфильтрации мягких тканей при флегмоне. Для отграничения трахеотомной раны нами разработан специальный доступ. C каждой из сторон в виде арки над трахеотомной раной книзу производят дугообразный разрез с оставлением кожного мостика не менее 15 мм . Мостик в виде арки над трахеостомой необходим для отграничения трахеотомной раны от основной раны шеи и предотвращения затекания в неё гноя. Далее разрез проводят от одного угла нижней челюсти, параллельно её нижнему краю до нижнего края подбородочного возвышения, после чего симметрично с контралатеральной стороны, до другого угла нижней челюсти. Второй разрез осуществляют вниз от первого, по средней линии шеи не доводя до трахеотомной раны, соединяясь с образованным ранее разрезом. При одностороннем поражении доступ осуществляют с одной стороны. При невозможности отграничения гнойного процесса на шее от трахеостомы приходится вынужденно накладывать трахеостому через гнойно-некротические ткани с высоким риском развития вторичного трахеобронхита вследствие затекания экссудата в трахею и инфицирования раны из трахеобронхиального дерева. Новизной приспособления является использование перфорированного кольца вокруг трахеостомической трубки, снабженного по внешнему диаметру герметично установленными относительно кольца отводящими трубками, выведенными из раны на шее. Для улучшения лечения больных и стандартизации подходов к оказанию анестезиологического и хирургического пособия нами сформулированы показания к выполнению основных видов трахеостомии при обширных флегмонах шеи. Показанием к плановой трахеостомии следует считать невозможность интубации трахеи из-за недостаточного открывания рта при ДН 1-2 степени и необходимость продолжения искусственной вентиляции легких у оперированных больных с длительным нахождением интубационной трубки в трахее. Контролируемая трахеостомия проводится после купирования острой дыхательной недостаточности любым известным способом при возникновении обоснованного сомнения в быстром выздоровлении больного или развитии осложнений гнойного процесса. Экстренное наложение трахеостомы следует выполнять при нарушении механики и ритма дыхания, частоте дыхательных движений 40 и более в минуту, ларингоспазме и невозможности интубации трахеи. Нами сформулирован алгоритм оказания хирургической помощи больным с обширными флегмонами шеи в сочетании с трахеостомой, позволяющий использовать охарактеризованные выше разработки с наибольшей эффективностью. В момент поступления больного в стационар необходимо определить обширность поражения гнойным процессом мягких тканей шеи и провести оценку тяжести дыхательной недостаточности. При дыхательной недостаточности I - II степени больные должны быть помещены в реанимационное отделение для предоперационной подготовки. Обязательным следует считать инсуффляцию кислорода через маску или носовые катетеры. При дыхательной недостаточности III - IV степени больного из приемного отделения направляют в операционный блок для решения вопроса о протезировании функции внешнего дыхания. Предпочтительным способом следует считать интубацию трахеи. При невозможности интубации следует провести коникотомию и наладить инсуффляцию кислорода в трахеобронхиальное дерево. После этого отсрочено наложить трахеостому. Следующим этапом оказания хирургической помощи является проведение операции по поводу флегмоны шеи. В случае наложения трахеостомы через интактные ткани рекомендуется применить предложенный нами способ хирургического лечения больных в сочетании с трахеостомой, который позволяет отграничить трахеотомную рану от гнойного процесса. Если трахеостома наложена через измененные гнойным процессом ткани, то следует применить приспособление для дренирования паратрахеостомической раны. С целью подтверждения эффективности предложенных нами тактических подходов проведен анализ как проспективно полученных в ходе лечения результатов, так ретроспективно собранных из историй болезни. Для проведения анализа адекватности диагностики флегмон шеи и их осложнений на догоспитальном этапе нами были условно выделены две группы ошибок: определение неправильного диагноза и определение неточного диагноза. Неправильным считался диагноз, который неизбежно повлек за собой выбор необоснованного метода лечения. К неточным диагнозам мы относили те, которые отличались от верифицированного, но повлиять на тактику лечения не могли. Выставленный при первом обращении в лечебное учреждение диагноз (позже выступивший как направительный диагноз) был неправильным у 11 (44%) больных группы A ; у 9 (47,4%) больных группы B ; у 16 (30,8%) больных группы C ; у 14 (33,3%) больных группы D . Суммарно по всем группам с неправильным диагнозом были направлены 50 (38,2%) пациентов. Неточная диагностика имела место в 8 (32%) случаях среди больных группы A ; в 5 (26,3%) случаях среди больных группы B ; в 10 (19,3%) случаях среди больных группы C ; 9 (21,4%) случаях среди больных группы D . В итоге с неточным диагнозом было направлено 22 (15,9%) пациента. Для определения адекватности газообмена требованиям организма в процессе оказания хирургической помощи были выделены три основных этапа: за 1-2 часа до протезирования проходимости дыхательных путей, через 5-10 минут после ее начала и через 5 часов после ее окончания. Проведенные исследования показали, что до протезирования проходимости дыхательных путей во всех группах наблюдались изменения в картине показателей кислотно-основного равновесия, свойственные респираторному ацидозу. В момент протезирования состояние кислотно-основного равновесия больных групп A , B и C улучшилось, ацидоз компенсировался. В группе D эти показатели не только не приблизились к нормальным, но даже несколько ухудшились. После окончания манипуляции состояние кислотно-основного равновесия больных групп A , B и D нормализовалось, явления ацидоза в значительной степени купировались. Следует отметить неполное устранение расстройств в группе C . Наиболее вероятной причиной этого считаем невозможность установки интубационной трубки требуемого диаметра. Как основной показатель эффективности профилактики инфекционных осложнений трахеостомии следует рассматривать уменьшение случаев трахеобронхита в опытных группах по равнению с контрольной. В группах A и B было по 7 случаев, в группе D – 28 случаев. В группе C , где трахеостомия не выполнялась, трахеобронхит развился у 3 больных. Для подтверждения эффективности применения доступа с оставлением «арки» проведено исследование частоты нагноений трахеостомической раны. Установлено, что частота нагноения трахеостомической раны в группах A и D , группах B и D статистически достоверно ( p <0,01) различается. Для оценки влияния способа лечения больного на микробный пейзаж операционной раны проведено исследование, включавшее двухкратный бактериологический посев – на 0-3 сутки и на 4-6 сутки. Исследование проводилось в аэробной среде. В период от момента первой хирургической обработки обширной флегмоны шеи до 3 суток послеоперационного периода в группах превалируют отрицательные результаты посевов. В период от 4 суток до 6 суток послеоперационного периода отмечается значительное снижение количества отрицательных результатов бактериологических посевов и увеличение роста аэробной микрофлоры. Так, в группах A , B и D снижение носит статистически достоверный характер ( p <0,05). Для подтверждения эффективности применения нового хирургического доступа проведено сравнительное исследование микрофлоры операционной раны шеи и трахеотомной раны. Разработанный хирургический доступ позволяет в 7 раз эффективнее защищать трахеостомическую рану от инфицирования микроорганизмами операционной раны, а устройство для предотвращения инфицирования трахеобронхиального дерева позволяет оградить рану в 3 раза эффективнее в сравнении со стандартными методами. Анатомическую безопасность предлагаемых хирургических доступов в сравнении с традиционными оценивали путем определения перкутанного напряжения кислорода в тканях. Проведен анализ динамики изменения TcPO 2 кожи лоскутов у основания и на верхушке лоскута, а также у основания и у свободного края кожной «арки». Измерение проводилось через 24 часа после операции и за 1 час до ушивания раны. Установлено, что через 24 часа после операции TcPO 2 значительно снижается, не достигая, однако, критических цифр ни в одной из групп. Полученные результаты подтверждают тот факт, что разработанный нами хирургический доступ безопасен при соблюдении технологии. Общие результаты лечения больных были разделены на три группы: непосредственные, ближайшие и отдаленные результаты. В группе A среднее количество дней , проведенных больным в стационаре, составило 22,7 койко-дня; в группе B – 23,9; в группе C – 17,9; в группе D – 31,3 койко-дня. Койко-день в группе A меньше, чем в группе D на 27,5%. Среднее количество дней от последней операции по поводу гнойного процесса до проведения пластической операции в группе A составило 16 дней; в группе B – 18,7; в группе C – 12,7; в группе D – 24,8 дня. Следует обратить внимание на меньшее значение этого показателя у больных группы A в сравнении с больными группы D на 35,5%. Частота повторных оперативных вмешательств в группе A составила 26,0%; в группе B – 31,6%; в группе C – 26,9%; в группе D – 50,0%. Предложенные нами хирургические доступы позволили снизить частоту повторных оперативных вмешательств на 48%. Летальность составила в группе A – 3 случая; в группе B – 2 случая; в группе C – 4; в группе D – 12 случаев. Летальность в группе A ниже летальности в группе D в 2,4 раза. [ Оценка ближайших результатов включала оценку функциональных и косметических результатов проводилась через 1-2 месяца после выписки больного из стационара. Доказано, что в контрольной группе D имеется бо ? льшее количество неудовлетворительных ближайших результатов лечения, чем в основных группах. Оценка отдаленных результатов включала оценку проходимости трахеи через 1 год после выписки из стационара. В группах A , B и C стенозы трахеи не выявлены ни в одном случае, в группе D подтвержден инструментальным методом диагноз стеноза трахеи у 2 больных. Считаем, что большая частота стенозов в группе D связана со значительной долей экстренных трахеостомий, выполнявшихся в лечебных учреждениях районов Краснодарского края. Таким образом, можно утверждать, что комплексное применение предложенной нами тактики лечения больных с обширными флегмон, хирургических доступов, инструмента для инсуффляции кислорода в ТБД и приспособления для дренирования паратрахеостомической раны, позволяет уменьшить летальность, сократить период нахождения больного в стационаре, уменьшить количество инфекционных осложнений со стороны трахеобронхиального дерева, добиться преобладания хороших и удовлетворительных ближайших косметических и функциональных результатов, а также предотвратить развитие стеноза трахеи. На основании приведенных данных мы сделали следующие выводы. • Основными недостатками в тактике хирургического лечения больных с ОФШ является недооценка стадии дыхательной недостаточности, приводящая к вынужденному проведению экстренной трахеостомии, и отсутствие четких показаний к наложению трахеостомы. • Использование приспособления для инсуффляции кислорода в трахеобронхиальное дерево – эффективный и безопасный метод лечения дыхательной недостаточности у больных с ОФШ, позволяющий предотвратить развитие осложнений при экстренной трахеостомии. • Разработанный способ хирургического лечения больных с ОФШ в сочетании с трахеостомой позволяет выполнить максимально радикальную хирургическую обработку за счет улучшения доступности операционной раны, а также в 2 раза уменьшает количество повторных операций и в 7 раз снижает количество трахеобронхитов, сокращая срок декануляции. • Использование приспособления для дренирования паратрахеостомической раны при обширных флегмонах шеи позволяет в 3 раза снизить количество трахеобронхитов при наличии трахеостомы, наложенной через гнойную рану. • Разработана тактика лечения больных с ОФШ в сочетании с трахеостомой, улучшающая результаты лечения за счет создания благоприятных условий для анестезиологического и хирургического пособия. Показано, что наиболее рациональным методом является проведение интубации трахеи, а трахеостомия – вынужденной операцией. • Применение предлагаемого способа хирургического лечения больных с ОФШ в сочетании с трахеостомой позволяет снизить количество осложнений и уровень летальности в 2,4 раза и уменьшить на 8,5 суток время пребывания больных в стационаре. Разрешите также представить Вашему вниманию практические рекомендации по лечению такой категории больных. • При дыхательной недостаточности I - II степени больного с ОФШ необходимо поместить в реанимационное отделение для предоперационной подготовки с обязательным выполнением инсуффляции кислорода в трахеобронхеальное дерево через маску или носовые катетеры. • При дыхательной недостаточности III - IV степени больного с ОФШ из приемного отделения направляют в операционный блок для решения вопроса о протезировании функции внешнего дыхания. • У больных с ОФШ при необходимости протезирования функции внешнего дыхания на дооперационном этапе методом выбора следует считать интубацию трахеи по бронхоскопу. • При невозможности интубации трахеи у больного с ОФШ следует выполнить коникотомию с помощью инструмента для инсуффляции кислорода в трахеобронхиальное дерево и провести трахеостомию при поддержке нормального газообмена путем струйной непрерывной ИВЛ кислородом через коникотомный доступ со скоростью 7-11 л/мин. • При наличии у больного ОФШ следует выполнять только нижнюю трахеостомию. • В случае наложения трахеостомы через интактные, не заинтересованные в гнойном процессе ткани, возможно применение способа хирургического лечения больных с ОФШ в сочетании с трахеостомой с отграничением трахеотомной раны от основного хирургического доступа с помощью арки. Рекомендуемый доступ позволяет отграничить трахеотомную рану от гнойного процесса на шее, предотвратить распространение его на рядом расположенные области, произвести тщательную ревизию и максимально радикальную хирургическую обработку гнойной раны. • Если трахеостома наложена через измененные гнойным процессом ткани, то следует применить приспособление для дренирования паратрахеостомической раны. Предложенный алгоритм оказания хирургической помощи больным с ОФШ в сочетании с трахеостомой может быть рекомендован врачам специализирующимся в области об щей, гнойной и челюстно-лицевой хирургии для выбора наиболее адекватного метода хирургического вмешательства. Благодарю за внимание! |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||